INTRODUCCIÓN
El cobre es un metal de color marrón. Pertenece al bloque d (primera serie de transición). Presenta una configuración electrónica [Ar]3d104s1, siendo sus estados de oxidación más frecuentes +1 y +2. Los compuestos de cobre (I y II) se van a diferenciar, entre otras características, en el color de sus compuestos y en sus propiedades magnéticas.
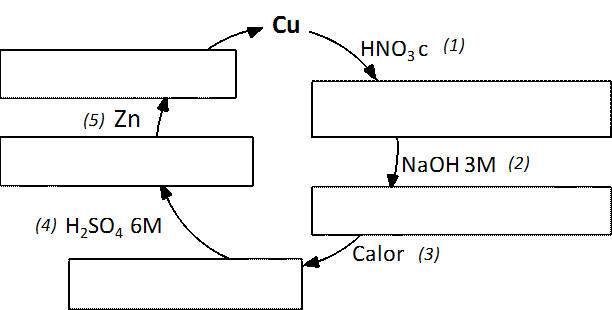
En esta práctica se pretende que, a partir de cobre y mediante sucesivas reacciones químicas, se formen diferentes compuestos de Cu(II) y en la última reacción se recupere el metal inicial, formando un ciclo de reacciones. Los alumnos podrán interpretar los hechos observados mediante las correspondientes reacciones químicas.
PARTE EXPERIMENTAL
Material
Vaso de precipitados de 250 mL |
Varilla de vidrio |
Probeta pequeña (15 mL) |
Büchner y kitasato |
Probeta grande (100 mL) |
Trípode |
Reactivos
Reactivos suministrados Reactivos a preparar por el alumno
Cobre H2SO4 6M
HNO3 concentrado HCl 6M
NaOH 3M (botella de 1 L)
H2SO4 concentrado
Zn (sólido)
| Datos: | Eº H+/H = -2,1 V; Eº H+/H2 = 0 V; Eº NO3-/NO2 = 0,8 V; |
| Eº Cu2+/Cu = 0,34 V; Eº Cu+/Cu = 0,52 V; Eº Cu2+/Cu+ = 0,16 V; |
Eº Zn2+/Zn = -0,76 V.
PROCEDIMIENTO
En la vitrina de gases se colocan 0.5 g de cobre en un vaso de precipitados de 250 mL y se añaden 4 mL de HNO3 concentrado (d = 1,38 g/ mL). Agitar con la varilla hasta disolución total del cobre y mantener el vaso en la vitrina hasta que cese el desprendimiento gaseoso.
Añadir 125 mL de agua y agitando con la varilla adicionar 30 mL de NaOH 3 M. Mantener 24 horas en reposo o calentar hasta transformación completa. Decantar el líquido sin perder precipitado; añadir al sólido 200 mL de agua templada, agitar, dejar reposar y volver a decantar.
Adicionar 15 mL de H2SO4 6M y agitar hasta disolución del precipitado. En la vitrina de gases añadir 2 g de Zn sólido, agitando hasta que el líquido sea incoloro. Cuando cese el desprendimiento gaseoso decantar el líquido y si queda algo de cinc sin disolver añadir 10 mL de HCl 6M y calentar sin que se produzca ebullición. Cuando cese el desprendimiento gaseoso decantar el líquido y recoger el cobre en un büchner por filtración a vacío.
CUESTIONES
1.Describir los fenómenos observados después de la adición de cada reactivo o en cada operación realizada (disolución de sólidos, cambios de color, desprendimiento de gases, precipitaciones,…).
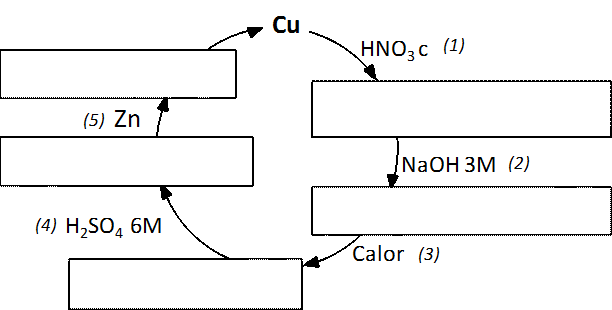
2.Formular el/los producto/s formado/s en cada uno de los casos.