7.2. Valoraciones óxido-reducción
Se utiliza de forma cuantitativa la transferencia de electrones que tiene lugar cuando reaccionan un oxidante y un reductor. Así, si se desea determinar la concentración de un oxidante o un reductor en una disolución problema, se hace reaccionar con un reductor o un oxidante cuya concentración sea perfectamente conocida. Los oxidantes más utilizados en volumetrías redox son: permanganato MnO4-, dicromato Cr2O72-, yodo I2 y sales de Ce(IV). Los reductores fuertes presentan el inconveniente de ser oxidados por el oxígeno del aire, por lo que no se emplean con demasiada frecuencia como reactivos valorantes. Los agentes moderadamente reductores cuyas disoluciones son estables pueden utilizarse como valorantes. Uno de ellos es el Na2S2O3, empleado con frecuencia para valorar I2.
La detección del punto final en volumetrías redox puede llevarse a cabo por métodos químicos (autoindicadores e indicadores redox) o métodos instrumentales.
AUTOINDICADORES: Si el reactivo valorante es fuertemente coloreado y los productos de la reacción son incoloros o presentan una coloración débil, el primer exceso de reactivo puede servir como autoindicador. El ejemplo más representetativo y clásico lo constituye el KMnO4. Su utilización se basa en que una sola gota de disolución 0,02 M basta para comunicar color rosa muy perceptible a varios centenares de mililitros de disolución incolora y no reductora.
INDICADORES REDOX: Un indicador redox es una sustancia orgánica cuya forma oxidada tiene un color diferente de la forma reducida. Los indicadores redox funcionan de manera análoga a los ácido-base, con la diferencia de que responden al potencial redox del sistema en lugar de hacerlo al pH.
MÉTODOS INSTRUMENTALES: Su fundamento es análogo al del pH-metro en volumetrías ácido-base. La diferencia está en el electrodo, se sustituye el electrodo de vidrio (sensible a los iones H3O+), por otro que indique el potencial de la disolución (por ejemplo uno de Pt). En las proximidades del punto de equivalencia se produce un cambio brusco de potencial. Esta forma de proceder se denomina valoración potenciométrica.
PARTE EXPERIMENTAL
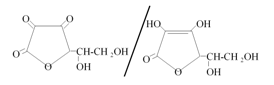
Valoración de ácido ascórbico (vitamina C) con una disolución patrón de I2 . (La concentración de la disolución patrón está anotada en la botella).
Objetivo: Determinar la riqueza en ácido ascórbico (H8C6O6) de un producto comercial, utilizando una disolución de yodo de concentración perfectamente conocida. Método:
A) Preparar la bureta con la disolución patrón, siguiendo el procedimiento descrito en las valoraciones ácido-base.
B) Pesar unos 200 mg del producto comercial problema y anotar el peso exacto. Introducirlos en un matraz Erlenmeyer de 250 mL y disolverlos en 5 mL de H2SO4 2M/40mL de agua, sin utilizar la varilla.
C) Valorar inmediatamente siguiendo el mismo procedimiento que en ácido-base y añadiendo solución indicadora (engrudo de almidón) cuando se aproxime el punto final (color marrón oscuro). Anotar el volumen consumido de disolución valorante.
| - | Repetir la valoración. |
| - | Lavar la bureta en su soporte y llenarla con agua destilada. |
Los pares redox implicados en la reacción son : I2 / I -