INTRODUCCIÓN
La TG (de manera análoga al caso de otras técnicas de análisis térmico) se define como la técnica en que se mide el peso de una muestra frente al tiempo (t) o a la temperatura (Tª) mientras se somete la muestra a un programa de variación de Tª controlado en una atmósfera específica.
El programa de variación de Tª puede consistir en mantener la Tª constante (isotermo), calentar a velocidad constante (es el más habitual junto al isotermo), enfriar o cualquier combinación de ellos.
Lo habitual es que se produzca una pérdida de peso pero también es posible que haya una ganancia de peso. La atmósfera puede ser estática o dinámica con un caudal determinado (también se emplean condiciones de presión reducida) y los gases más habituales son N2, aire, Ar, CO2.
Una característica fundamental de la TG es que sólo permite detectar procesos en los que se produce una variación de peso tales como descomposiciones, sublimaciones, reducción, desorción, absorción, etc mientras que no permite estudiar procesos como fusiones, transiciones de fase, etc.
La curva resultante de la representación del cambio de masa frente a la temperatura proporciona información sobre la estabilidad térmica y composición del producto inicial, de los compuestos intermedios y la composición del residuo final.
El objetivo de la experiencia es tener un primer contacto con las técnicas de análisis térmico en un caso sencillo como es la comprobación de la fórmula del sulfato de cobre hidratado mediante termogravimetría.
PARTE EXPERIMENTAL
Material
Cápsula de porcelana
Varilla de vidrio
Placa calefactora
CuSO4.5H2O
Datos
Pesos atómicos: Cu (63,55); S (32,07); O (16,00); H (1,00)
DETERMINACIÓN EXPERIMENTAL
Se coge una cápsula de porcelana limpia y seca. Se pesa y se anota el peso exacto de la cápsula vacía. A continuación, se tara la balanza y se pesa en ella una cantidad exacta, entre 3 y 5 g, de sulfato de cobre pentahidrato.
Se sitúa la cápsula con el producto en un baño de arena y se calienta a unos 300ºC, removiendo el sólido con la varilla de vidrio para conseguir un calentamiento homogéneo.
Cuando el producto, inicialmente de color azul, queda de color prácticamente blanco, se retira del baño y se deja enfriar. Una vez fría la cápsula se pesa de nuevo.
CÁLCULOS
Sabiendo que el CuSO4.5H2O pierde las cinco moléculas de agua cuando se calienta a 300 °C, calcular el tanto por ciento de pérdida de masa teórico y compararlo con el práctico.
EJERCICIO
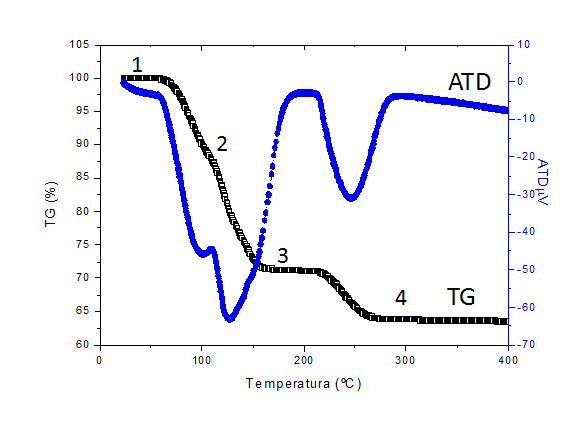
Los equipos de medida actuales nos permiten obtener datos con mucha mayor precisión y con muy pequeñas cantidades de muestra. Así, realmente, el CuSO4.5H2O cuando se calienta a 300 °C, pierde las moléculas de agua en tres etapas diferentes.
Con los datos de la siguiente Tabla (aportados por el equipo), que corresponden a la gráfica mostrada a continuación, calcular cuantas moléculas de agua se pierden en cada una de las etapas.
ETAPA |
TEMPERATURA (ºC) |
MASA (mg) |
1 |
46,9 |
10,36 |
2 |
105,8 |
8,84 |
3 |
188,8 |
7,38 |
4 |
304,3 |
6,62 |
CUESTIONES
1.Indique a qué se debe el cambio de color del producto que se produce durante el calentamiento.
2.Si se continuase el calentamiento, se observaría el desprendimiento de un gas de olor picante y el sólido de la cápsula adoptaría un color oscuro. Indique la reacción que se produciría y a la formación de qué compuesto se debe el color oscuro.