4. Técnicas de separación

TÉCNICAS DE SEPARACIÓN
Video: Filtración Filtros cónicos
Video: Filtración Filtros de pliegues
Video: Decantación
4.1. Purificación y cristalización de CuSO4.5H2O
4.2. Separación de una mezcla agua-tetracloruro de carbono
4.3. Destilación
Las mezclas son una combinación de sustancias puras (elementos o compuestos químicos) que no reaccionan entre ellas y no pierden sus propiedades estando juntas. Estas se pueden clasificar como homogéneas o heterogéneas.
Una mezcla homogénea es aquella cuya composición y propiedades son uniformes en toda su extensión. Sus componentes no se pueden distinguir por encontrarse todos ellos en una sola fase y estar distribuidos regularmente. Ejemplos: el aire, el agua con sal …..
En una mezcla heterogénea la composición y las propiedades son diferentes en diferentes puntos. Los componentes se pueden observar a simple vista o con instrumentos de laboratorio, porque estos se distribuyen en forma irregular o en fases. Ejemplos: agua con aceite, la sangre, ….
Para realizar cualquier separación de los componentes de una mezcla primero debemos saber el estado físico, características y propiedades de cada uno de los componentes. Además hay que tener en cuenta que las técnicas ó métodos de utilizados para separar los componentes de una mezcla no pueden alterar la naturaleza de las sustancias que la componen.
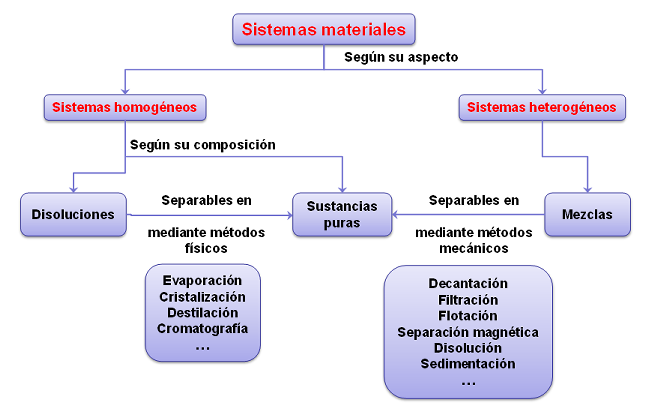
SEPARACIÓN DE MEZCLAS HETEROGÉNEAS ð MÉTODOS MECÁNICOS
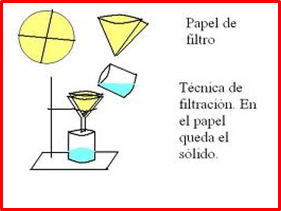
FILTRACIÓN
Se utiliza para separar mezclas heterogéneas entre sólidos y líquidos. Se fundamenta en que alguno de los componentes de la mezcla no es soluble en el otro, se encuentra uno sólido y otro líquido. Se hace pasar la mezcla a través de una placa porosa o un papel de filtro, el cual retendrá al sólido llamado precipitado y el líquido denominado filtrado pasará a través del filtro hacia un recipiente.
Se pueden separar sólidos de partículas sumamente pequeñas, utilizando papeles de filtro ó placas con el tamaño de los poros adecuados. Normalmente se utiliza papel de filtro, aunque si la disolución atacase el papel (ej. ácidos fuertes concentrados o sustancias muy oxidantes) se deberán emplear placas filtrantes de otro material (ej. de vidrio poroso). Además la filtración puede hacerse a presión normal (por gravedad) o a presión reducida (a vacio):
Filtración a presión normal: utilizaremos embudo de vidrio y papel de filtro, que según su forma hablaremos de filtro cónico (a) o filtro de pliegues (b)
|
|
| (a) | Filtro cónico ð Este tipo de filtro va a ser utilizado cuando lo que nos interesa conservar es el sólido precipitado, y el tiempo que dure el proceso de filtración carece de importancia. Mediante papel de filtro se construye un cono de papel, tal y como se indica en la figura, de modo que pueda formarse un cono que se adapte al embudo. Una vez encajado, se humedece con agua destilada para fijarlo al embudo. |
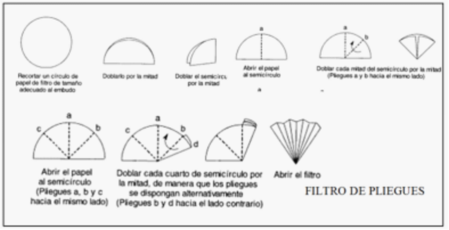
| (b) | Filtro de pliegues ðSi se requiere mayor rapidez en la filtración y/ó lo que interesa es la disolución, se utilizará un filtro de pliegues, doblando adecuadamente el papel de forma que presente la mayor superficie posible. |
Filtración a presión reducida:
Para una filtración a vacío se utilizará un embudo cerámico (Büchner) (Porcelana agujereada) en lugar del embudo corriente. Este embudo irá acoplado a un kitasato (Erlenmeyer provisto de acodamiento lateral) mediante unos conos de goma o tapón adecuado, y el kitasato irá unido a una trompa de agua que provocará la succión por vacío (efecto Venturi). Sobre el fondo del Büchner se coloca un papel de filtro cortado a la medida exacta. Dicho papel se humedecerá ligeramente para que quede adherido a la superficie del Büchner durante la filtración. A continuación, se vierte la mezcla a separar y se abre la trompa. Procurar desconectar el kitasato del generador de vacío antes de cerrar éste, sobre todo en caso de trompas de agua, ya que la diferencia de presiones hará que el agua pase al líquido del kitasato, impurificándolo o diluyéndolo.
|
|
LAVADO DE PECIPITADOS: El sólido que se separa del seno de una disolución estará contaminado por las impurezas solubles presentes en la misma, por tanto, es necesario un proceso final de lavado. Para ello se vierte un disolvente (en el cual no sea soluble el precipitado) sobre la parte superior del filtro. La operación deberá repetirse varias veces, utilizando pequeñas fracciones del disolvente cada vez.
DECANTACIÓN
La decantación se basa en la diferencia de densidad entre los componentes de una mezcla. Se utiliza para separar líquidos inmiscibles entre ellos y de diferente densidad (a) o sólidos de líquidos inmiscibles entre ellos con diferente densidad (b)
a) Para separar líquidos inmiscibles en dos fases utilizamos el denominado embudo o ampolla de decantación, en el cual se coloca la mezcla, se deja en reposo hasta que la sustancia más densa sedimente en el fondo. Luego dejamos caer el líquido por el tubo de goteo cayendo en otro recipiente y dejando arriba solamente uno de los dos líquidos. Ej: Una mezcla de agua aceite ó agua mercurio
|
|
|
b) Cuando se separa un sólido de un líquido por decantación, ej. CuO y agua ó arena y agua, dejamos sedimentar el sólido, más denso y después se vierte el líquido sobrenadante (sedimentación – decantación)
CENTRIFUGACIÓN
Es la separación en dos fases(sólida y liquida) mediante la fuerza centrifuga originada en la centrifugadora, sistema (mecánico o eléctrico), que hace girar la muestra a gran velocidad, lo que acelera la separación de fases con respecto a las otras técnicas en que sólo se emplea la fuerza gravitatoria.
|
|
Es un procedimiento que se utiliza cuando se quiere acelerar la sedimentación. Se coloca la mezcla dentro de una centrifuga, la cual tiene un movimiento de rotación sobre un eje constante y rápido, lográndose que las partículas de mayor densidad, se vayan al fondo y las más livianas queden en la parte superior.
SEPARACION MAGNÉTICA
Se fundamenta en la propiedad de algunos materiales, ferro o ferrimagnéticos, de ser atraídos por un imán y, por lo tanto, separados al aplicar un campo magnético.
DISOLUCIÓN/EXTRACCIÓN
Consiste en la adición de un disolvente a una mezcla de sólidos para extraer la sustancia que se quiere en la disolución o viceversa y separando ambas por filtración.
Ej: Separación de una mezcla de arena (SiO2) / sal (NaCl) o purificación de sustancias mediante procesos de extracción. Ej: Purificación y cristalización de CuSO4. 5H2O impuro (práctica 4.1)
TAMIZADO
Consiste en separar partículas sólidas de acuerdo a su tamaño. En la práctica, consiste en utilizar coladores o tamices de diferentes tamaños de luz de malla, colocados de forma consecutiva, en orden decreciente, de acuerdo al tamaño de la luz de la malla. Es decir, los de luz de malla más grande se sitúan en la parte superior y los de menor luz de malla en la inferior. Los tamices, que pueden ser de tamaños muy diferentes, están elaborados con telas metálicas.

SEPARACION DE MEZCLAS HOMOGÉNEAS (SEPARACIÓN DE DISOLUCIONES)ð MÉTODOS FÍSICOS
EVAPORACIÓN Y CRISTALIZACIÓN
Este método se utiliza para separar sustancias sólidas disueltas en un líquido, aprovechando el paso del componente líquido a vapor quedando como residuo el sólido. Puede realizarse de forma lenta por evaporación del líquido a temperatura ambiente o bien rápida llevando a ebullición la solución hasta evaporación total del líquido se trata de extraer un sólido que está disuelto en un líquido.

Evaporación ðConsiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no tenemos interés en utilizar el componente evaporado. Los otros componentes quedan en el envase. Puede realizarse también a temperatura ambiente en recipientes abiertos, cristalizadores, evaporándose el disolvente de forma lenta.
Cristalización ðPara efectuar la cristalización de un sólido hay que partir de una disolución sobresaturada, entonces dejamos que se enfríe, su solubilidad disminuye y entonces el soluto empieza a separarse del disolvente en forma de cristales sólidos que se van depositando.
Existen varias formas de sobresaturar una disolución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del disolvente (por ejemplo con la evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar. La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la cristalización puede hacerse una “siembra” raspando las paredes del recipiente
DESTILACIÓN
Se utiliza cuando se quieren separar varias sustancias liquidas que forman una disolución (mezcla homogénea) y estas tienen una temperatura de ebullición diferente como una mezcla de agua y alcohol etílico o bien, un sólido no volátil disuelto en un líquido, como una mezcla de cloruro de sodio disuelto en agua. La destilación, como proceso consta de dos fases: en la primera, el líquido pasa a vapor y en la segunda el vapor se condensa, pasando de nuevo a líquido en un matraz distinto al de destilación.
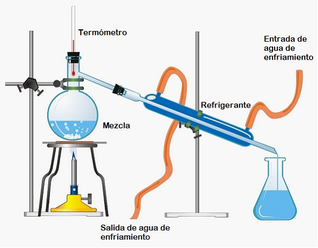
Los tipos de destilación más comunes son:
−Destilación Simple: El proceso se lleva a cabo en una sola etapa, es decir, que se evapora el líquido de punto de ebullición más bajo (mayor presión de vapor) y se condensa por medio de un refrigerante.
−Destilación fraccionada: El proceso se realiza en varias etapas por medio de una columna o torre de destilación en la cual, se llevan a cabo continuamente numerosas evaporaciones y condensaciones. Al ir avanzando a lo largo de la columna, la composición del vapor es más concentrada en el componente más volátil y la concentración del líquido que condensa es más rica en el componente menos volátil. Cabe mencionar que este tipo de destilación es mucho más eficiente que una destilación simple y que mientras más etapas involucre, mejor separación se obtiene de los componentes.
− Destilación por arrastre con vapor: Proceso en el que se hace pasar una corriente de vapor a través de la mezcla de reacción y los componentes que son solubles en el vapor son separados. Entre las sustancias que se pueden separar por esta técnica se pueden citar los aceites esenciales.
Existen sustancias que, en ciertas proporciones, forman mezclas llamadas azeotrópicas que se caracterizan porque su vapor tiene la misma composición que la fase líquida y que, por tanto, no se pueden separar por destilación. Un ejemplo típico es la mezcla etanol/agua (95.6 / 4.4 %) cuyo punto de ebullición a una atmósfera es 78.2 ºC. Por encima de esta temperatura el destilado presenta una composición constante e igual a la fase líquida.
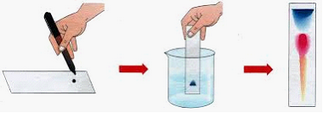
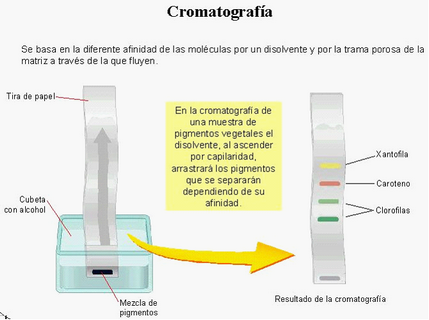
CROMATOGRAFIA
Se basa en la diferente velocidad con la que cada componente de la disolución es arrastrado sobre una superficie porosa por la acción de un disolvente que se distribuye por capilaridad
Videos
Para ver los videos pulse con el ratón sobre la imagen o el pie de imagen, del que quiera visualizar.